Клинические и иммунологические аспекты Т-клеточной вакцинотерапии у больных прогредиентной формой рассеянного склероза
Медицинская иммунология 2012, Т. 14, № 1-2, стр. 103-108 © 2012, СПб РО РААКИ
Оригинальные статьи
Селедцова Г.В.1, Иванова И.П.1, Мамаев С.В.2, Селедцов Д.В.1, Малкова Н.А.4, Литвинова Л.С.3, Селедцов В.И.3
1 НИИ клинической иммунологии CD РАМН, г. Новосибирск
2Клиническая больница № 85, Москва
3 Балтийский федеральный университет им. И. Канта, г. Калининград
4 Областной центр рассеянного склероза, г. Новосибирск
Резюме. Тридцать девять пациентов с прогредиентной формой рассеянного склероза (РС) были многократно иммунизированы аутологичной поликлональной T-клеточной вакциной. Через 2 года после начала вакцинотерапии у 16 (41%) пациентов признаков прогрессии заболевания отмечено не было, у 5 (13%) было зарегистрировано неврологическое улучшение. Из 22 пациентов контрольной группы, не получавших иммунотерапевтического лечения, только у 6 (27%) была отмечена стабилизация болезни, а неврологического улучшения не было зарегистрировано ни в одном случае. В группе (n = 26), получавшей Ребиф, стабилизация заболевания была зарегистрирована у 11 (42%) пациентов. Неврологическое улучшение было отмечено у 1 (4%) пациента из этой группы. Через год после начала лечения у вакцинированных пациентов регистрировался подъем уровня сывороточного IL-10, тогда как уровень IL-17 и IL-18 оставался на исходных значениях. У этих больных была отмечена корреляция между уровнем антимиелиновых антител и уровнем взаимодействующих с ними антиидиотипических антител. В целом, полученные результаты предполагают, что поликлональная Т-клеточная вакцинация может быть эффективным методом лечения РС не только на ранних, но и на поздних стадиях заболевания. Ключевые слова: Т-клеточная вакцинотерапия, рассеянный склероз, цитокины, антимиелиновые антитела, антиидиотипические антитела.
Seledtsova G., Ivanova I., Mamaev S., Seledtsov D., Malkova N., Seledtsov V.
CLINICAL AND IMMUNOLOGICAL ASPECTS OF T CELL-BASED VACCINE THERAPY IN PATIENTS
with progredient multiple sclerosis
Abstract. Thirty-nine patients with a progredient clinical form of chronic multiple sclerosis (MS) were subject to multiple immunization with autologous polyclonal T-cell vaccines. Two years after initiating the vaccine therapy, no evidence for disease progression was noted in 16 patients (41% of total). Neurological improvement was observed in five cases (13%) from the vaccine-treated group. Of 22 control MS patients who did not receive the immunotherapy, only 6 persons (27%) exhibited stabilization of their clinical state. Clinical improvement was not detectable among this group of MS patients. A group of twenty-six MS patients was treated with Rebif, without evidence of disease progression in eleven cases (42%), and distinct neurological improvement noted in one patient (4%) from this group. One year after starting the vaccine therapy, a rise in serum IL-10 was detected in vaccine-treated patients, whereas IL-17 and IL-18 serum levels remained within the initial ranges. A correlation between the serum levels of anti-myelin antibodies and appropriate
— anti-idiotypic antibodies was revealed in these patients. In general, the results obtained suggest polyclonal T-cell vaccination as a potentially effective treatment approach, both at early and more advanced stages of the disorder. (Med. Immunol., 2012, vol. 14, N1-2, pp 103108)
Адрес для переписки:
Селедцова Галина Викторовна,
НИИ клинической иммунологии СО РАМН 630099, г. Новосибирск, ул. Ядринцевская, 14. Тел.: (383) 236-06-40.
Факс: (383) 228-26-73.
E-mail: galina-seledtsova@yandex.ru
Keywords: Т-cell vaccination, multiple sclerosis, cytokines, antimyelin antibodies, anti-idiotypic antibodies.
Введение
Считается, что ключевая роль в патогенезе рассеянного склероза (РС) принадлежит CD4+T- хелперным клеткам первого типа (ТЫ), способным в присутствии нейрональных антигенов активироваться и продуцировать провоспалительные медиаторы, такие как INFy, фактор некроза опухоли-а и IL-2. Посредством локальной продукции провоспалительных цитокинов ТЫ привлекают в очаг воспаления эффекторные цитотоксические клетки (макрофаги, CD8M- клетки и др.) и создают благоприятные условия для реализации их цитотоксического потенциала [3, 4, 5]. У 95% больных РС в цереброспинальной жидкости обнаруживаются IgG антитела олигоклонального происхождения. Определение этих антител имеет диагностическую значимость. Миелин—реактивные антитела могут участвовать в разрушении миелина с вовлечением системы комплемента или клеточных эффекторов. Во втором случае механизм антителозависимой цитотоксичности реализуется через FcR- опосредуемое взаимодействие [5, 6]. В свете изложенного выше очевидно, что иммунотропное лечение РС должно быть направлено на инактивацию аутоиммунных Т- и B-лимфоцитов и подавление, осуществляемой иммунокомпетентными клетками, продукции провоспалительных медиаторов. В нашей лаборатории разработана 2-этапная технология получения Т-клеточной антиидиотипической вакцины [1, 2], используемой для лечения больных РС. Целью настоящего исследования была оценка клинической эффективности метода Т-клеточной вакцинации в лечении прогредиентной формы РС и изучение иммунологических механизмов, лежащих в основе ее возможного терапевтического эффекта.
Материалы и методы
Пациенты. Исследование было выполнено в рамках протокола клинических испытаний, утвержденного ученым советом и одобренного этическим комитетом НИИ клинической иммунологии СО РАМН. В исследование были включены пациенты с вторично-прогредиентной формой течения заболевания. Исследуемая группа была сформирована из пациентов, многократно иммунизированных поликлональной Т-клеточной вакциной в течение 2 лет. Контрольную группу составили пациенты (n = 22), наблюдавшиеся в Областном центре рассеянного склероза (г. Новосибирск), сопоставимые с пациентами основной группы по возрасту, длительности и течению заболевания.
Для сравнения результатов лечения была также сформирована группа пациентов, получавшая в течение 2 лет препарат Ребиф (Rebif, Merk), который представляет собой человеческий рекомбинантный интерферон-бета 1. Неврологический статус всех обследованных пациентов оценивали по функциональной шкале Куртцке с использованием расширенной шкалы инвали- дизации (EDSS). Улучшение состояния считали значимым, если значение EDSS снижалось за период наблюдения на 0.5 пункта и более. Прогрессия заболевания регистрировалась при увеличении значения EDSS более чем на 0,5 пункта. Состояние пациента оценивали как стабильное при отсутствии изменений значения EDSS.
Приготовление поликлональной Т-клеточной вакцины. Разработанная технология получения Т-клеточной вакцины состоит из двух последовательных этапов. Первый этап включает в себя культивирование МНК (2×106/мл) пациента в среде RPMI 1640, содержащей 10% инактивированной аутологичной плазмы, 5 мМ Hepes, 2 мМ L-глутамина, 5×10-5 М-меркаптоэтанола и антибиотики, в присутствии 50 мкг/мл миелина свиньи (все реагенты были получены от компании Sigma, США). На втором этапе клетки наращивали посредством неспецифической митогенной стимуляции фитогеммагглютини- ном P (ФГА, 5 мкг/мл, Sigma) и рекомбинантным интерлейкином 2 (IL-2, 100 ед/мл, «Биотех», С.-Петербург) [1]. По окончании культивирования клетки инактивировали облучением или фиксацией в формалине и хранили в жидком азоте до момента использования. Общее количество полученных от одного больного клеток варьировало в пределах 18-27×107, одна вакцинальная доза составляла в среднем 18×106 клеток.
Т клеточная вакцинация. Индуцирующий курс иммунотерапии состоял из 4 еженедельных Т-клеточных вакцинаций. Поддерживающее лечение включало в себя вакцинации с интервалом в один месяц. Клетки вводили подкожно в межлопаточную область спины.
Пролиферативный ответ. МНК, выделенный из крови методом градиентного центрифугирования, культивировали в концентрации 2×105/ лунку с 50 мкг/мл миелина в 96-луночном круглодонном планшете во влажной атмосфере с 5% СО2 втечение 96 ч. Пролиферацию оценивали стандартным методом по включению радиоактивного тимидина.
Определение концентрации цитокинов. Концентрацию цитокинов (IL-17, IL-18, IL-10) в образцах сыворотки крови определяли иммуноферментным анализом с помощью тест-систем компании «Вектор-Бест» (г. Новосибирск), согласно инструкции производителя.
Определение уровня нейротропных антител. Образцы сывороток крови для анализа замораживали и отправляли в медицинский исследовательский центр «Иммункулус» (Москва), где антитела (АТ) определяли с использованием ЭЛИ-Тестов, согласно инструкциям производителя.
Статистический анализ. Статистическую обработку результатов проводили с использованием критерия U Вилкоксона—Манна—Уитни, или парного критерия Стьюдента.
Результаты
Как показано в таблице 1, у 21 (53,8%) из 39 вакцинированных пациентов неврологический статус за 2 года не претерпел ухудшения. Это означает, что у этих пациентов болезнь не прогрессировала. В контрольной группе (n = 22), не получавшей лечения, процент таких пациентов оказался в два раза меньше — 27% (табл. 2). Неврологическое улучшение было отмечено у 5 (13%) вакцинированных пациентов. В контрольной группе ни одного случая улучшения зафиксировано не было. Клиническая эффективность T-клеточной вакцинации была сопоставима с эффективностью лечения Ребифом. У 11 (42%) из 26 пациентов, получавших ребиф, неврологических признаков прогрессии заболевания отмечено не было (табл. 3). Только у 1 пациента (4%) из этой группы имело место неврологическое улучшение. Полученные данные суммированы в таблице 4. Т-клеточную вакцинацию пациенты переносили без серьезных побочных эффектов, все они не меняли привычного образа жизни. Побочные эффекты Ребифа были в целом характерными для препаратов этой группы.
Для оценки иммунологической эффективности Т-клеточной вакцинации, был исследован пролиферативный ответ МНК на миелиновые антигены у 19 многократно вакцинированных больных. Исследования проводили до и через 1 год после начала лечения. Как показано на рисунке 1, результатом вакцинотерапии было более чем двукратное снижение пролиферативного ответа МНК на миелин (P < 0,05).
Хорошо известно, что реализация иммунорегуляторного потенциала Т-лимфоцитов осуществляется через продукцию цитокинов. Ранее нами было показано снижение концентрации IFNy и увеличение уровня IL-4 в сыворотке крови многократно вакцинированных пациентов [2]. Данные настоящего исследования свидетельствуют, что поликлональная Т-клеточная вакцинация не оказывала существенного влияния на уровень сывороточного IL-17 и IL-18. Вместе с тем, у вакцинированных было отмечено достоверное увеличение уровня сывороточного IL-10 (табл. 5).
Согласно существующим представлением, аутоантитела вносят значимый вклад в развитие РС. Как показано в таблице 6, через 6 мес. после начала Т-клеточной вакцинации была выявлена тенденция к снижению в кровотоке концентрации антимиелиновых антител, а также достоверное снижение уровня антиидиотипических антител (Р < 0,05), способных связывать миелин- специфичные антитела.
Таблица 1. Клиническая характеристика больных, прошедших курс т-клеточной вакцинотерапии
| № | Ф. И./ возраст пол | Длительность заболевания (годы) | Степень тяжести заболевания | EDSS | |
| До лечения | Через 2 года после начала лечения | ||||
| 1 | Г Е./32 ж. | 15 | IV | 6 | 6 |
| 2 | Б. Н./33 ж. | 14 | II | 3.5 | 3.5 |
| 3 | Г А./25 ж. | 7 | III | 5 | 5 |
| 4 | К. Г/47 ж. | 14 | Ш | 6.5 | 7 |
| 5 | С. В./29 ж. | 4 | II | 4.5 | 4.5 |
| 6 | С. Е./30 ж. | 3 | III | 4 | 3.5 |
| 7 | Д. А./27 м. | 8 | IV | 7 | 7 |
| 8 | Г. Ю./30 ж. | 11 | III | 5 | 6 |
| 9 | К. Ю./40 м. | 15 | IV | 7 | 7 |
| 10 | Л. Т./46 ж. | 8 | III | 5.5 | 5.5 |
| 11 | М. В./53 м. | 9 | IV | 6 | 8 |
| 12 | К. Е./23 ж. | 7 | IV | 6 | 6.5 |
| 13 | Ж. Л./43 ж. | 7 | III | 4 | 4.5 |
| 14 | Е. Ю./29 ж. | 9 | III | 5 | 5 |
| 15 | В. И./33 ж. | 3 | IV | 6 | 7 |
| 16 | Г Н./51 ж. | 13 | IV | 6 | 7 |
| 17 | Р Д./26 м. | 7 | IV | 6.5 | 6.5 |
| 18 | Г. Е./31 м. | 6 | IV | 6.0 | 6.0 |
| 19 | О. И./29 ж. | 11 | IV | 6.5 | 6.5 |
| 20 | Б. Д./44 м. | 9 | Ш | 5.5 | 6 |
| 21 | Д. М./26 ж. | 10 | I | 2.5 | 2.5 |
| 22 | Т И./37 ж. | 7 | IV | 7 | 7.5 |
| 23 | К. А./26 м. | 8 | II | 3.5 | 3.5 |
| 24 | Л. Л./33 ж. | 11 | III | 4.5 | 3 |
| 25 | М. О./36 ж. | 12 | I | 2.5 | 2.5 |
| 26 | О. Л./47 ж. | 9 | III | 4.5 | 4.5 |
| 27 | П. О./48 м. | 13 | IV | 7 | 7.5 |
| 28 | П. М./43 ж. | 15 | I | 2.5 | 1.5 |
| 29 | П. Л./40 ж. | 8 | I | 2.5 | 1.5 |
| 30 | Р К./40 м. | 7 | III | 5 | 5.5 |
| 31 | Р Ж./25 ж. | 6 | III | 5 | 4.5 |
| 32 | С. С./30 ж. | 10 | I | 2 | 3 |
| 33 | С. Н./54 ж. | 15 | IV | 6.5 | 6 |
| 34 | С. Н./49 ж. | 13 | III | 4.5 | 5.5 |
| 35 | С. М./46 ж. | 15 | I | 2.5 | 3 |
| 36 | Т. М./26 м. | 5 | IV | 6.5 | 7 |
| 37 | Т. Л./29 ж. | 8 | II | 4 | 5 |
| 38 | Ф. И./23 ж. | 6 | I | 2.5 | 3 |
| 39 | Х. Э./40 ж. | 10 | II | 4 | 5 |
Таблица 2. Клиническая характеристика больных (n = 22), не получавших лечения
(контрольная группа)
| № | Ф. И./ возраст пол | Длительность заболевания (годы) | Степень тяжести заболевания | EDSS | |
| На момент начала наблюдения | Через 2 года после начала наблюдения | ||||
| 1 | Р Е./30 м. | 4 | II | 2 | 3 |
| 2 | М. Л./50 ж. | 17 | III | 5.5 | 5.5 |
| 3 | М. Т./50 ж. | 10 | IV | 7 | 75 |
| 4 | М. Л./62 ж. | 2 | III | 4.5 | 5.0 |
| 5 | С. Л./49 ж. | 3 | III | 4.5 | 4.5 |
| 6 | П. Т./35 ж. | 3 | IV | 6.5 | 7.0 |
| 7 | С. В./48 ж. | 12 | IV | 6.5 | 7.5 |
| 8 | С. Т./53 ж. | 23 | IV | 6.5 | 6.5 |
| 9 | Б. А./42 м. | 25 | III | 3.0 | 5.0 |
| 10 | Б. Н./37 ж. | 11 | IV | 6.0 | 6.0 |
| 11 | В. Н./42 ж. | 17 | II | 3.5 | 3.5 |
| 12 | В. С./42 ж. | 5 | IV | 7.0 | 7.5 |
| 13 | В. В./58 ж. | 33 | II | 3.0 | 3.5 |
| 14 | К. С./43 м. | 1 | III | 4.0 | 4.5 |
| 15 | К. Т/52 ж. | 17 | III | 5.5 | 5.5 |
| 16 | К. Н./30 ж. | 2 | III | 3.5 | 6.0 |
| 17 | М. Т./58 ж. | 6 | III | 5.0 | 6.5 |
| 18 | М. Л./51 ж. | 5 | IV | 5.5 | 7.0 |
| 19 | К. Л./47 ж. | 16 | II | 3.0 | 4.5 |
| 20 | М. Г./52 ж. | 20 | IV | 6.0 | 6.5 |
| 21 | К. Т/57 ж. | 35 | III | 4.0 | 4.5 |
| 22 | К. Н./40 ж. | 11 | III | 5.5 | 6.5 |
таблица 3. клиническая характеристика больных, получавших лечение препаратом ребиф
| № | Ф. И./ возраст пол | Длительность заболевания (годы) | Степень тяжести заболевания | EDSS | |
| На момент начала наблюдения | Через 2 года после начала наблюдения | ||||
| 1 | А. С./32 м. | 4 | Ш | 4 | 5 |
| 2 | Б. И./44 ж. | 13 | III | 3 | 3.5 |
| 3 | Б. И./46 ж. | 15 | III | 3.5 | 3.5 |
| 4 | Б. Н./38 ж. | 20 | III | 4.0 | 6.5 |
| 5 | Б. Ю./53 ж. | 24 | III | 4.0 | 6.0 |
| 6 | В. Т./58 ж. | 33 | II | 3.5 | 3.5 |
| 7 | В. Н./57 ж. | 5 | II | 2.0 | 3.5 |
| 8 | Д. И./46 ж. | 2 | II | 3.0 | 3.0 |
| 9 | Е. Е./56 м. | 3 | III | 5.5 | 6.0 |
| 10 | К. А./54 ж. | 8 | II | 3.5 | 3.5 |
| 11 | К. А./18 ж. | 3 | III | 4.5 | 6 |
| 12 | М. Д./38 ж. | 4 | IV | 3.5 | 4.0 |
| 13 | М. Л./34 ж. | 10 | III | 4.5 | 4.5 |
| 14 | М. В./52 м. | 4 | IV | 6.0 | 6.0 |
| 15 | М. Н./38 ж. | 8 | III | 4.0 | 5.5 |
| 16 | П. Т./38 ж. | 14 | IV | 6.0 | 7.0 |
| 17 | П. М./34 ж. | 16 | IV | 4.5 | 5.0 |
| 18 | П. Л./54 ж. | 17 | II | 3.0 | 3.0 |
| 19 | Р Г./42 ж. | 10 | III | 5.5 | 4.5 |
| 20 | Т И./47 ж. | 20 | III | 1 | 3 |
| 21 | Т В./43 м. | 23 | III | 5 | 4 |
| 22 | Ф. В./57 ж. | 6 | III | 3.5 | 4.5 |
| 23 | Х. А./60 ж. | 21 | IV | 6 | 6.5 |
| 24 | Х. Н./61 ж. | 24 | III | 5 | 5 |
| 25 | Ш. Е./37 м. | 15 | III | 4.5 | 4.5 |
| 26 | К. Е./48 м. | 9 | III | 4.5 | 6.0 |
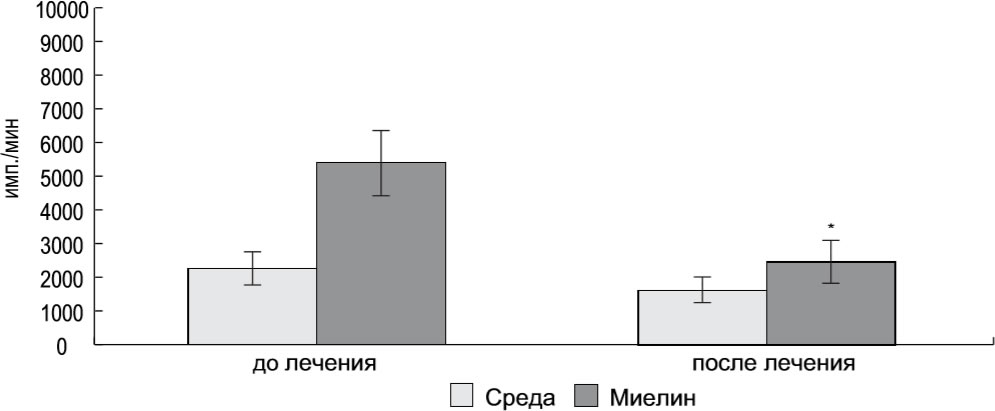
Рисунок 1. Пролиферативный ответ МИК пациентов (n = 19) на миелиновые антигены до и через 1 год после начала иммунотерапевтического лечения
примечание. * P < 0,05 — в сравнении с ответом до начала лечения.
Таблица 4. Cравнительная характеристика результатов лечения пациентов
| Группа | Состояние не изменилось или улучшилось | Состояние ухудшилось |
| Т-клеточная вакцинация (n = 39) | 21/39 (53,8%)* | 18/39 (46,2%) |
| Ребиф (n = 26) | 11/26 (42,4%) | 15/26 (57,6%) |
| Контроль (n = 22) | 6/22 (27,3%) | 16/22 (72,7%) |
Примечание. * - р < 0,05 в сравнении с группой, не получавшей лечения.
Таблица 5. Содержание сывороточных цитокинов (пг/мл) у больных в процессе проведения т-клеточной вакцинации (n = 15, мужчин и женщин в возрасте)
| Цитокин | До лечения | После начала лечения (месяцы) | ||
| 6 | 9 | 12 | ||
| IL-17 | 8,3±3,7 | 7,2±1,6 | 5,6±2,3 | 6,2±2,0 |
| IL-18 | 91,6±11,2 | 66,8±8,6 | 112,2±23,8 | 95,8±9,4 |
| IL-10 | 4,4±1,2 | 3,7±1,0 | 2,3±1,3 | 11,66±4,0* |
Примечание. * - р < 0,05 по сравнению с показателем до лечения.
Таблица 6. Содержание антимиелиновых и днтиидиотипичЕских ат (условные единицы) у больных рс (n = 13) в процессе проведения т-клеточной вакцинации
| Антитела | До лечения | Т-клеточная вакцинация (месяцы) | ||
| 3 мес. | 6 мес. | 12 мес. | ||
| Антимиелиновые антитела | 22,4±11,2 | 9,6±21,3 | 18,0±8,3 | 16,5±9,9 |
| Антиидиотипические антитела | 25,9±15,5 | 9,8±13,7 | 11,4±3,5* | 5,2±13,2 |
Примечание. * - р < 0,05 по сравнению с показателями до лечения.
Обсуждение
Ранее было показано, что поликлональная Т-клеточная вакцинация может быть эффективно использована в лечении ремиттирующей формы РС [2, 3, 7]. Прогредиентная форма РС, как правило, менее чувствительна к терапевтическим воздействиям. В настоящей работе впервые показана целесообразность применения Т-клеточной вакцинации на относительно поздних стадиях заболевания, когда иммунологические механизмы, контролирующие аутоиммунные и провоспалительные реакции, становятся неспособными прервать патологический процесс. Полученные данные дают основу для предположения, что даже на поздних стадиях аутоиммунного заболевания, идиотип-антиидиотипическая регуляция остается чувствительной к эндогенным стимулам. Этот факт открывает новые возможности для иммунотропного лечения многих пациентов с продвинутыми стадиями аутоиммунного заболевания, стандартное лечение которых не дает желаемых результатов.
Обращает на себя внимание отсутствие побочных эффектов T-клеточной вакцинации. Это особенно важно для длительно болеющих пациентов, чье здоровье является скомпрометированным не только болезнью, но и ее лечением.
Отсутствие побочных эффектов дает преимущество T-клеточной вакцинотерапии над лечением, основанным на использовании интерфе- ронов. Побочные эффекты интерферонотерапии во многих случаях являются причиной их отмены. Иммунологические эффекты Т-клеточной вакцинации являются достаточно долговременными, поскольку антиидиотипическая реактивность пролонгируется механизмом иммунной памяти [8]. Эффекты интерферонотерапии часто прерываются с момента прекращения больным приема препарата. Интересно, что у части вакцинированных пациентов было отмечено неврологическое улучшение. Это указывает на возможность сохранения у ЦНС определенного регенеративного потенциала даже на поздних стадиях РС. Остановка аутоиммунного патологического процесса создает необходимые условия для реализации этого потенциала.
Достоверное снижение пролиферативного ответа лимфоцитов вакцинированных пациентов на миелин свидетельствует об общем снижении количества миелин-реактивных клеток в кровотоке. Ранее у вакцинированных больных было показано снижение уровня сывороточного IFNy и увеличение концентрации IL-4 и IL-10 [2] в сыворотке крови. Эти данные указывают на перестройку Т-клеточного ответа в сторону доминирования ^2-иммунных реакций. Согласно результатам настоящего исследования, T-клеточная вакцинация способна значимо повысить сывороточный IL-10 не только на ранних, но и на поздних стадиях заболевания.
Можно предполагать, что системная хелперная перестройка является необходимым условием для формирования идиотип-специфического иммунного ответа. В действительности, выраженное воспаление, скорее всего, мешает работе высокоспецифического иммунного механизма, отвечающего за элиминацию идиотип-несущих аутоиммунных Т-клеток из организма. С другой стороны, индуцируемая Т-клеточной вакцинацией Т-хелперная перестройка, по-видимому, не затрагивает существенным образом продукцию IL-17 и IL-18, которые согласно литературным данным могут играть важную роль в развитии аутоиммунного воспаления [10, 11, 12, 13]. В дальнейшем представляет интерес оценить концентрационную динамику этих цитокинов у пациентов, подвергнутых вакцинотерапии на ранних стадиях болезни.
Провоспалительные Т-клеточные реакции у больных РС ассоциируются с усилением синтеза антимиелиновых антител. Роль В-клеточного ответа в развитии аутоиммунных заболеваний неоднозначна. Продукция B-клетками цитокинов и синтез АТ может опосредовать как про- тективный, так и тканедеструктивный процесс. Первый, как правило, связан с синтезом наивными В-клетками IL-10 и продукцией плазматическими клетками АТ, способствующих удалению из кровотока клеточного дебриса, аутоантигенов [9]. Переход наивных В-клеток в активированные В-клетки часто ассоциируется с развитием иммунопатологического процесса [9]. Теоретически, повышение уровня сывороточного IL-10 и снижение концентрации сывороточного IFNy должно препятствовать развитию тканедеструктивного В-клеточного иммунитета [9, 13]. В наших исследованиях четко проявила себя тенденция корреляции уровня антимиелиновых АТ с уровнем взаимодействующих с ними антиидиотипических AT Мы не увидели у вакцинированных пациентов четкого повышения уровня анти-идиотипи- ческих АТ Возможно, Т-клеточная вакцинация способствует каким-то образом восстановлению баланса между тканедеструктивными АT и факторами, блокирующими их активность.
В целом, наши данные указывают на важность системных иммунологических сдвигов у вакцинированных больных РС, общий вектор действия которых направлен на сдерживание патологических воспалительных процессов в организме. Важно, что эти сдвиги могут быть индуцированы на поздних стадиях аутоиммунного заболевания.
Список литературы
1. Иванова И.П.. Селедцов В.И., Банул Н.В., Самарин Д.М., Селедцова Г.В., Савкин И.В., Ширинский В.С., Пронкина Н.В., Козлов В.А. Получение Т-клеточной вакцины и ее применение для лечения рассеянного склероза // Мед. Иммунология. — 2005. — Т. 7, № 1. — С. 27-32.
2. Иванова И.П., Селедцов В.И., Селедцова Г.В., Мамаев С.В., Потемкин А.В., Селедцов Д.В., Козлов В.А. Индукция антииди- отипического иммунного ответа аутологичной Т-клеточной вакциной у больных рассеянным склерозом // Клеточные технологии в биологии и медицине. — 2008. — № 3. — С. 145-149.
3. Stinissen P, Zhang J., Vandevyver C., Hermans G., Raus J. Gammadelta T cell responses to activated T cells in multiple sclerosis patients induced by T cell vaccination // J. Neuroimmunol. — 1998. — N 87. — P. 94-104.
4. Giuliani F., Yong V Immune-mediated neurodegeneration and neuroprotection in MS // Int. MS J. — 2003. — N 10. — P. 122-130.
5. Giuliani F., Goodyer C., Antel J., Yong V Vulnerability of human neurons to T cell-mediated cytotoxicity // J. Immunol. — 2003. — N. 171. — P. 368-379.
6. Okun E., Mattson M., Arumugam T Involvement of Fc receptors in disorders of the central nervous system // Neuromolecular Med. — 2010. — N 12 (2). — Р. 164-178.
7. Correale J., Lund B., McMillan M., Ko D., McCarthy K., Weiner L. T cell vaccination in secondary progressive multiple sclerosis // J. Neuroimmunol. — 2000. — N 107. — P. 130-139.
8. Correale J., Farez M., Gilmore W Vrccines for Multiple Sclerosis : Progress to Date // CNS Drugs. — 2008. — N 22. — P. 175-198.
9. Orduno N., Quach T, Sanz1 I. B cells and immunological tolerance // J. Invest. Dermatol. — 2009. — Vol. 129 (2). — P. 278-288.
10. Gutcher I., Urich E., Wolter K., Prinz M., Becher B. Interleukin 18-independent engagement of interleukin 18 receptor-alpha is required for autoimmune inflammation // Nat. Immunol. — 2006. — N 7. — P. 946-953.
11. Nicoletti F., Di Marco R., Mangano K., Patti F., Reggio E., Nicoletti A., Bendtzen K., Reggio A. Increased serum levels of interleukin-18 in patients with multiple sclerosis // Neurology. — 2001. — N 57 (2). — P. 342-344.
12. Huang WX., Huang P., Hillert J. Increased expression of caspase-1 and interleukin-18 in peripheral blood mononuclear cells in patients with multiple sclerosis // Multiple Sclerosis Jornal. — 2004. — N 10. — P. 482-487.
13. Gutcher I., Becher B. APC-derived cytokines and T cell polarization in autoimmune inflammation // J. Clin. Invest. — 2007. — Vol. 117. — P. 1119-1127.
поступила в редакцию 28.07.2011 принята к печати 16.10.2011
