Клинико-иммунологическая эффективность вакцинотерапии при диссеминированной меланоме кожи
УДК: 616.5-006.81:615.371:612.017.1
М.А. Оуровцева, А.А. Шишков, г.в. Оеледцова, В.А. Козлов
НИИ клинической иммунологии СО РАМН, г. Новосибирск
630099, г. Новосибирск, ул. Ядринцевская, 14, e-mail: mfelde@ngs.ru
Проведено изучение эффективности вакцинотерапии у 29 больных с диссеминированной меланомой кожи, которые были иммунизированы полиантигенной вакциной, состоящей из разрушенных мышиных меланомных (B16) и карциномных (LLC) клеток. Индуцирующий курс вакцинотерапии состоял из 5 подкожных иммунизаций с недельным и 5 с двухнедельным интервалом. Поддерживающий курс состоял из ежемесячных иммунизаций. Показано, что вакцинотерапия способна значительно улучшить показатели 3-летней выживаемости, которая равнялась 24 %, против 3 % в группе контроля. Кроме того, сочетание вакцинотерапии с оперативным лечением повышает ее эффективность. Развитие клинического эффекта разной степени выраженности обусловлено увеличением продукции сывороточного INF-y, отражающего активацию клеточного звена противоопухолевого иммунитета, тогда как повышенный уровень IL-4 в сыворотке крови у пациентов с диссеминированной меланомой кожи до начала проведения вакцинотерапии прогнозируется с неблагоприятным исходом заболевания.
Ключевые слова: меланома, вакцина, клеточный и гуморальный иммунитет.
CLINICAL-IMMUNOLOGICAL EFFICIENCY OF VACCINOTHERAPY IN ADVANCED SKIN MELANOMA
M.A. Surovtseva, A.A. Shishkov, G.V Seledtsova, VA. Kozlov
Research Institute of Clinical Immunology, RAMS SB, Novosibirsk
14, Yadrintsevskaya Street, 6340099-Novosibirsk, e-mail: mfelde@ngs.ru
Twenty nine advanced melanoma skin patients were treated with a polyantigenic vaccine, prepared from murine melanoma (B16) and carcinoma (LLC) cells. Inducing course of vaccinotherapy consisted of 5 subcutaneous immunizations with a week and 5 with two-week intervals. A consolidating treatment included monthly vaccinations. The vaccinitherapy was shown to improve 3-year survival rate (24 % versus 3 % in the control group). Moreover, combination of immunotherapy and surgery was found to be effective in the advanced melanoma treatment. Different clinical effect was explained by the increase in production of serum INF-y reflecting the activation of cells of anti-tumor immunity reactivity, whereas the elevated level of serum IL-4 prior to vaccinotherapy was associated with poor prognosis in patients with advanced skin melanoma.
Key words: melanoma, vaccine, cell and humoral immunity.
Диссеминированная меланома кожи является крайне неблагоприятным в прогностическом отношении заболеванием, которому свойственно агрессивное течение и быстрая дальнейшая генерализация опухолевого процесса. Проблема лечения меланомы кожи продолжает оставаться актуальной, так как увеличивается заболеваемость и смертность во всех странах мира и отсутствуют качественные успехи в лечении данной патологии [1]. В настоящее время активная специфическая иммунотерапия представляет собой одно из наиболее перспективных направлений в лечении и профилактике онкологических заболеваний [2]. По данным литературы известно, что клетки меланомы несут на своей поверхности большое количество опухолеассоциированных антигенов (ОАА) и вакцинация этими антигенными пептидами может приводить к формированию устойчивого противоопухолевого иммунитета [11, 12, 15]. Однако сами по себе пептиды низкоиммуногенны, кроме того, развитие иммунного ответа на одну или несколько опухолеассоциированных детерминант зачастую не приводит к замедлению развития опухолевого процесса, а лишь дает селективные преимущества для роста тем опухолевым клеткам, которые не экспрессируют эти детерминанты [13]. В связи с этим иммунизация организма опухолевыми клетками выглядит более предпочтительной, поскольку позволяет одновременно индуцировать иммунные реакции на широкий спектр ОАА.
Основным ограничением по использованию аутологичных опухолевых клеток является низкая иммуногенность их антигенов. Применение аллогенных опухолевых вакцин также сопряжено с определенными ограничениями, главным из которых является различие HLA-антигенов пациента и клеток вакцины, что может влиять на эффективность вакцинотерапии [5].
В то же время в многочисленных экспериментальных работах было показано, что использование чужеродных (ксеногенных) опухолевых клеток значительно повышает иммуногенность вакцины и обеспечивает протекцию от опухолей за счет индукции у вакцинируемых животных специфического клеточного и гуморального ответа к ОАА собственных опухолей [4, 7, 9, 14]. Кроме того, было выявлено наличие высокой степени гомологии между ОАА человека и мыши [10]. Несмотря на то, что к настоящему времени накоплено большое количество экспериментальных данных по использованию ксеногенных опухолевых клеток, в литературе отсутствуют данные по их клиническому применению.
Основной целью данной работы являлось изучение влияния вакцинотерапии на клеточное и гуморальное звенья иммунитета, а также оценка ее клинической эффективности у пациентов с диссеминированной меланомой кожи.
Материал и методы
Клинические исследования проводились в соответствии с протоколом, утвержденным Ученым советом и Этическим комитетом Института клинической иммунологии СО РАМН. От каждого пациента, участвующего в исследовании, было получено информированное согласие. В исследование было включено 29 пациентов (20 женщин и 9 мужчин) с диссеминированной меланомой кожи в возрасте от 23 до 67 лет. Из них 15 больных (51,7 %) исходно имели I–II стадию заболевания и в анамнезе оперативное вмешательство в объеме широкого иссечения первичного очага; 14 больным (48,3 %) с IIB-III стадией заболевания было проведено комбинированное лечение: широкое иссечение первичной опухоли с лимфаденэктомией регионарных лимфатических узлов и курсами полихимиотерапии.
Все больные основной группы на начало вакцинации имели прогрессирование заболевания, и время от начала прогрессирования заболевания до начала вакцинотерапии составляло от 0 до 13 мес (1,9 ± 0,47 мес). Исходный уровень функциональной активности по Карновскому составлял не менее 70 %. Пациенты не получали химиотерапевтического лечения в течение 2 мес до момента начала, а также в течение всего периода проведения вакцинотерапии.
Иммунотерапию проводили ксеногенной вакциной, приготовленной на основе лизатов клеток опухолей меланомы B16 и карциномы LLC мыши [С57В1/6 (B6, H-2b)] [3]. Индуцирующий курс вакцинотерапии состоял из 5 подкожных иммунизаций с недельным и 5 — с двухнедельным интервалом. Поддерживающий курс состоял из ежемесячных иммунизаций. Иммунореактивность пациентов была оценена до и после проведения индуцирующего курса вакцинотерапии.
Клеточную иммунореактивность оценивали путем введения 100 мкл антигенного раствора (2 мг/мл) опухолевых клеток B16, LLC и нормальных спленоцитов мыши внутрикожно в область средней трети внутренней поверхности предплечья. Учет реакции гиперчувствительности замедленного типа (ГЗТ) производили через 24 ч [3].
Для оценки антиген-индуцированной бласттрансформации лимфоцитов мононуклеарные клетки периферической крови помещали в 96-луночный круглодонный планшет (Linbro, Великобритания) в количестве 2*105 на лунку и культивировали в присутствии клеточных лизатов растворимых антигенов (5*104 на лунку) в среде RPMI 1640, содержащей 10 % аутологичной плазмы, 5 mM HEPES, 2 mM L-глютамина (все реактивы фирмы Sigma) и антибиотики, в течение 120 ч при температуре 37°С во влажной атмосфере с 5 % СО2 Клеточные лизаты вакцинальных и аллогенных антигенов готовили согласно методике [3]. Уровень пролиферации оценивали по включению меченого 3Н-тимидина, вносимого в дозе 1 мкКю на лунку за 6 ч до окончания культивирования. Индекс стимуляции (ИС) рассчитывали по формуле:
ИС = опыт (имп/мин) / контроль (имп/мин).
Уровень сывороточных IFN-y и IL-4
Таблица 1
| Характеристика больных | Основная группа (n=29) | Контрольная группа (n=29) |
| Мужчины | 9 (31 %) | 9 (31 %) |
| Женщины | 20 (69 %) | 20 (69 %) |
| Средний возраст, годы | 49,3 ± 2,4 (от 23 до 67) | 48,3 ± 2,2 (от 24 до 75) |
| Локализация метастазов: легкие | 10 (34 %) | 6 (21 %) |
| печень | 7 (24 %) | 7 (24 %) |
| лимфатические узлы, мягкие ткани | 21 (72 %) | 25 (86 %) |
| другие локализации (мозг, кости и др.) | 6 (29 %) | 7 (24 %) |
| Предшествующее лечение: хирургическое | 15 (51,7 %) | 18 (62,1 %) |
| хирургическое + химиотерапия | 14 (48,3 %) | 11 (37,9 %) |
| Лечение на фоне диссеминации: хирургическое | 14 (48,3 %) | 13 (44,8 %) |
| без хирургического лечения | 15 (51,7 %) | 16 (55,2 %) |
Характеристика пациентов сравниваемых групп
с диссеминированной меланомой кожи определяли иммуноферментным методом с использованием наборов («Вектор-Бест», Кольцово, Россия), согласно инструкциям компании производителя.
Уровни специфических антител к вакцинальным антигенам определяли непрямым иммуноферментным методом. В качестве источника антигена использовали белковые растворы, полученные из клеточных лизатов. Антигенный раствор (200 мкг/мл) вносили в планшет в объеме 50 мкл на лунку и оставляли на ночь при температуре +4°С. После тщательных отмывок в лунки вносили 4 % казеиновый буфер («Вектор-Бест», Кольцово, Россия) для блокировки неспецифического связывания. Образцы тестируемых сывороток в разведении 1: 100 вносили в планшет в объеме 50 мкл на лунку. После инкубирования в течение 1 ч при 37°С планшет промывали и затем вносили в лунки конъюгат моноклональных антител с пероксидазой хрена («Вектор-Бест», Кольцово, Россия). Фотометрию проводили на ELISA-процессоре «Labsystems Multiskan MS» при длине волны 492 нм.
Клиническая эффективность вакцинотерапии была оценена по данным 3-летней выживаемости 29 вакцинированных пациентов. Группу контроля составили 29 пациентов с диссеминированной меланомой кожи, которые не получали вакцинотерапию. Пациенты, составлявшие группу контроля, были сопоставимы с основной
группой по полу, возрасту, локализации и распространенности опухолевого процесса. У 18 больных (62,1 %) из группы контроля была I–II стадия заболевания и в анамнезе выполнено оперативное вмешательство в объеме широкого иссечения первичного очага; 11 больных (37,9 %) с IIB—III стадией заболевания получили комбинированное лечение (табл. 1).
Статистическую обработку полученных данных проводили методами непараметрической статистики (критерии Вилкоксона и Манна-Уитни); выживаемость пациентов оценивали критерием Kaplan & Meier с использованием стандартного пакета программ прикладного статистического анализа (Statistica. for Windows 6.0).
Результаты и обсуждение
Показатели 3-летней выживаемости пациентов в основной группе достоверно отличались от контрольных значений (рис. 1). К концу срока наблюдения количество выживших в контрольной группе составило 3 % (1 больной), в основной группе — 24 % (7 пациентов) (р=0,009). Клинический эффект разной степени выраженности (полный, частичный ответ, стабилизация болезни) продолжительностью не менее 3 мес был достигнут у 18 (62 %) пациентов.
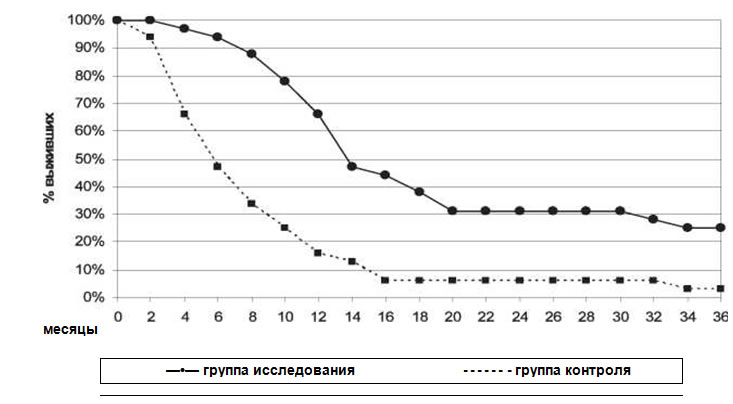
Рис. 1. Трехлетняя выживаемость вакцинированных больных (n=29) и пациентов контрольной группы (n=29) с диссеминированной меланомой кожи от момента генерализации заболевания.
Примечание: * - различия статически значимые по сравнению с группой контроля (р=0,008)
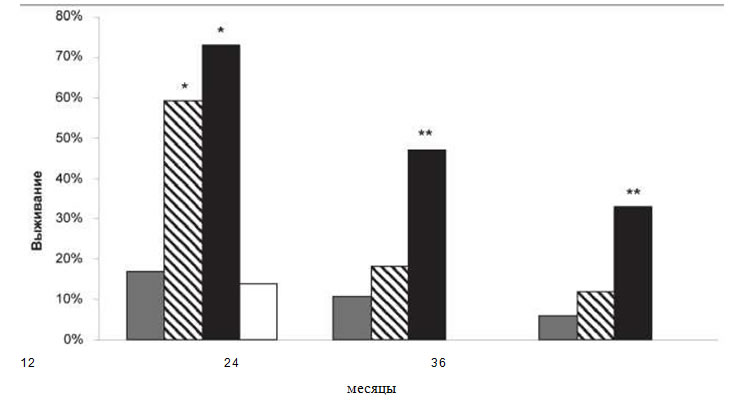
Рис. 2. Трехлетняя выживаемость пациентов с диссеминированной меланомой кожи от момента генерализации заболевания, получавших вакцинотерапию в монорежиме и в сочетании с хирургическим лечением. Примечание: 1 — больные, не оперированные на фоне прогрессирования заболевания (группа контроля); 2 — группа пациентов, получавших вакцинотерапию;
3 — группа пациентов, получавших вакцинотерапию в сочетании с операцией;
4 — больные, оперированные на фоне прогрессирования заболевания (группа контроля); * - различия статистически значимые по сравнению с группой контроля (р<0,01); ** * - различия статистически значимые по сравнению с группой контроля (р<0,05)
На фоне проведения вакцинотерапии 14 пациентам (48,3 %) основной группы и 13 пациентам (44,8 %) группы контроля, на фоне прогрессирования заболевания, было проведено иссечение подкожных метастазов и лимфодиссекция пораженных лимфатических узлов. При сравнении показателей выживаемости группы пациентов, получавших вакцинотерапию, с группой контроля, не оперированных на фоне прогрессии
заболевания, были выявлены достоверные различия через 12 мес после начала прогрессирования (р<0,01). Анализ выживаемости пациентов, получавших курс вакцинации в сочетании с хирургическим лечением, выявил достоверное увеличение этих показателей в течение всего
Таблица 2
Содержание сывороточных цитокинов (М + m) до и после проведения индуцирующего
курса вакцинации у пациентов с диссеминированной меланомой кожи с разной
степенью выраженности клинического эффекта
| Группы | До лечения | После курса лечения | ||||
| больных | INF-y, пг/мл | IL-4, пг/мл | INF-у /IL-4 | INF-y, пг/мл | IL-4, пг/мл | INF-y /IL-4 |
| 1-я группа (n=9) | 666,9 ± 269,3 | 34,6 ± 22,1 | 62,2 ± 25 | 1139 ± 333,7 | 54,6 ± 25,8 | 74,9 ± 34,1 |
| 2-я группа (n=7) | 518 ± 349,1 | 128 ± 40,2* | 8,6 ± 5,4 | 632,6 ± 339,7 | 390,6 ± 231,1 | 42,7 ± 26,8 |
Примечание: 1-я группа — наличие клинического эффекта разной степени выраженности; 2-я группа — отсутствие клинического эффекта (прогрессирование); * - различия между группами статически значимые (p=0,01).
срока наблюдения по сравнению с группой контроля, в которую входили оперированные на фоне прогрессии заболевания (рис. 2).
У группы пациентов с прогрессированием процесса до начала лечения выявлено статистически значимое увеличение концентрации сывороточного IL-4 (р=0,01) в сравнении с группой пациентов с полученным клиническим эффектом (табл. 2).
По данным кожных тестов после индуцирующего курса вакцинотерапии у группы пациентов с клиническим эффектом выявлено увеличение уровня клеточной реактивности на вакцинальные антигены в сравнении с группой пациентов с отсутствием клинического эффекта (табл. 3). Так, у группы пациентов с клиническим эффектом размер кожного пятна на вакцинальные антигены меланомы и карциномы в 2,4 и 2,5 раза был больше соответствующих показателей у группы пациентов с прогрессированием. В последнем случае размер кожного пятна на вакцинальные антигены меланомы был близок к нижней границе нормы, а на вакцинальные антигены карциномы так и не достиг размера положительной реакции, составив 8 мм.
В реакции бласттрансформации лимфоцитов у пациентов с достигнутым клиническим эффектом была выявлена тенденция к увеличению ИС как на вакцинальные, так и на аллогенные антигены (меланомы и карциномы). В группе пациентов с прогрессированием зарегистрированы низкие показатели пролиферативной активности лимфоцитов на специфические антигены (табл. 3).
Повышенный титр специфических антител к антигенам вакцины после индуцирующего курса вакцинотерапии был выявлен как у пациентов группы с клиническим эффектом, так и в группе с прогрессией. Кроме того, у группы пациентов с прогрессией была отмечена тенденция к увеличению титра антител и к ОАА, и к антигенам контроля в сравнении с группой пациентов с клиническим эффектом (табл. 4).
Использование вакцинотерапии как одного из вариантов специфической иммунотерапии позволяет индуцировать пролиферацию эффектор- ных клеток и/или усиливать уже существующий противоопухолевый иммунный ответ. Несмотря на большое количество существующих подходов к вакцинотерапии опухолей, вакцинотерапия ксеногенными клетками еще не получила должного развития. В экспериментальных работах было показано, что ксеногенные опухолевые клетки являются высокоиммуногенными и вызывают образование специфического СD8+ Т- клеточного и гуморального ответа к ОАА собственных опухолей [7, 10].
Эффективность вакцинотерапии в индукции противоопухолевого иммунитета подтверждается результатами того, что вакцинация может пролонгировать жизнь больных с диссеминированной формой заболевания. В нашей работе 3-летняя выживаемость у больных, получавших вакцинотерапию, равнялась 24 %, медиана выживаемости — 13 мес. При этом сроки выживания больных зависели от уровня индукции клеточных противоопухолевых реакций. Так, медиана выживаемости пациентов с высокой иммунореактивностью на ОАА вакцины после индуцирующего курса по данным кожных тестов была в 2 раза выше по сравнению с группой пациентов с низкой иммунореактивностью (данные не представлены). В своей работе мы показали, что проведение паллиативных циторедуктивных операций с целью уменьшения токсического иммуносупрессорного опухолевого влияния на организм пациента на фоне вакцинотерапии приводит к значимому увеличению выживаемости данной категории больных.
Полученные результаты свидетельствуют о том, что специфическая иммунотерапия с использованием данной вакцины способна стимулировать противоопухолевый клеточный иммунитет. После индуцирующего курса вакцинотерапии тенденция к увеличению продукции INF-y у группы пациентов с клиническим эффектом сопровождалась увеличением уровня клеточной реактивности, оцененной в реакциях ГЗТ и пролиферации на вакцинальные и аллогенные антигены в сравнении с группой пациентов с прогрессией. Причем наблюдается стимуляция преимущественно меланомаспецифических Т-лимфоцитов, что и обусловливает более выраженный иммунный ответ на мела- номные вакцинальные антигены.
В настоящее время роль гуморального звена в противоопухолевой защите организма остается до конца не ясной. Во многих работах отмечено
Реакции ГЗТ и пролиферации у пациентов с диссеминированной меланомой кожи
с разной степенью выраженности клинического эффекта после индуцирующего курса
вакцинотерапии (м ± m)
Таблица 3
|
Показатель |
1-я группа (n=18) |
2-я группа (n=11) |
|
Реакция ГЗТ (мм) |
||
|
Вакцинальные ОАА меланомы |
26 ± 3,0* |
11 ± 3,2 |
|
Вакцинальные ОАА карциномы |
20 ± 3,6** |
8 ± 2,4 |
|
Контроль на вакцинальные антигены |
6,5 ± 1,9 |
3,1 ± 1,2 |
|
Пролиферация (ИС) |
||
|
Вакцинальные ОАА меланомы |
10,9 ± 1,5 |
7,0 ± 3,2 |
|
Вакцинальные ОАА карциномы |
13,9 ± 2,6 |
10,9 ± 5,4 |
|
Контроль на вакцинальные антигены |
6,9 ± 1,7 |
3,9 ± 1,7 |
|
Аллогенные ОАА меланомы |
4,3 ± 2,7 |
1,4 ± 0,6 |
|
Аллогенные ОАА карциномы |
3,4 ± 2,4 |
1,7 ± 0,5 |
|
Контроль на аллогенные антигены |
1,09 ± 0,01 |
1,07 ± 0,02 |
Примечание: 1-я группа — наличие клинического эффекта; 2-я группа отсутствие клинического эффекта (прогрессирование);
* - различия между группами статистически значимые (p=0,01); ** - различия между группами статистически значимые (p=0,03).
уровни антител (м + m, титр) в реакции иФА к антигенам вакцины у группы пациентов
с диссеминированной меланомой кожи с разной степенью выраженности клинического
эффекта до и после индуцирующего курса вакцинотерапии
Таблица 4
| Группы больных | До лечения | После курса лечения | ||||
| ОАА меланомы | ОАА карциномы | Антигены контроля | ОАА меланомы | ОАА карциномы | Антигены контроля | |
| 1-я группа (n=12) | 149,8 ± 34,1 | 381,3 ± 101,1 | 207,3 ± 45,2 | 262,3 ± 48,3** | 557,4 ± 124,2** | 268,2 ± 48,4 |
| 2-я группа (n=7) | 107,1 ± 16,7 | 396,3 ± 104,1 | 242,4 ± 52,2 | 350,4 ± 47,1* | 590,7 ± 96,3 | 411,9 ± 46,0* |
Примечание: 1-я группа — наличие клинического эффекта разной степени выраженности; 2-я группа — отсутствие клинического эффекта (прогрессирование); * - различия в сравнении с показателем до лечения статистически значимые (р<0,03); ** - различия в сравнении с показателем до лечения статистически значимые (р<0,05).
наличие прямой корреляции между величиной сывороточных IgM, IgG к ОАА и уровнем общей и безрецидивной выживаемости пациентов [6, 8, 9], хотя имеются данные, опровергающие эти результаты. Так, было выявлено наличие обратной корреляции между титром IgG к меланома- ассоциированному гликопротеину (90-kDa) и выживаемостью при меланоме. В нашей работе мы показали отсутствие возрастания уровня специфических противоопухолевых антител на фоне увеличения меланомаспецифического клеточного ответа у группы пациентов с достигнутым клиническим эффектом (табл. 3, 4). С другой стороны, сдвиг иммунитета в сторону Th2 ответа до начала проведения лечения был характерен для группы пациентов, у которых не удалось достичь клинического эффекта на фоне проведения вакцинотерапии. Для данной группы пациентов после курса вакцинотерапии была выявлена и тенденция к увеличению продукции антител как к опухолевым так и к неопухолевым антигенам контроля (табл. 4). Таким образом, возможно, неблагоприятный исход заболевания связан со сдвигом ответа в сторону гуморального противоопухолевого ответа.
Таким образом, сочетание вакцинотерапии с иссечением подкожных метастазов и лимфодиссекцией пораженных лимфатических узлов приводит к увеличению сроков выживания пациентов с диссеминированной меланомой кожи.
C другой стороны, вакцинотерапия пациентов с меланомой приводит к развитию меланомаспецифического противоопухолевого ответа, преимущественно клеточного типа. При этом развитие клинически значимого эффекта связано с исходным уровнем продукции IL-4.
Литература
1. Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2005 г. // Вестник РОНЦ им. Н.Н. Блохина РАМН. 2007.Т. 18, № 2 (Прил. 1). 156 с.
2. Моисеенко В.М. Возможности вакцинотерапии меланомы кожи // Практическая онкология. 2001. № 4. С. 58-64.
3. Селедцов В.И., ФельдеМ.А., Самарин ДМ. и др. Иммунологические и клинические аспекты применения ксеновакцинотера- пии в лечении меланомы // Российский онкологический журнал. 2006. № 4. С. 23-29.
4. BergmanP.J., McKnight J., Novosad A. et al. Long-term survival of dogs with advanced malignant melanoma after DNA vaccination with xenogeneic human tyrosinase: a phase I trial // Clin. Cancer Res. 2003. Vol. 9. P. 1284-1290.
5. Berzofsky J.A., Terabe M., Oh S.K. et al. Progress on new vaccine strategies for the immunotherapy and prevention of cancer // J. Clin. Invest. 2004. Vol. 113. P. 1515-1525.
6. ChungM.H., Gupta R.K., Hsueh E.C. et al. Humoral immune response to a therapeutic polyvalent cancer vaccine after complete resection of thick primary melanoma and sentinel lymphadenectomy // J. Clin. Oncol. 2003. Vol. 21. P 313-319.
7. GrafN., Adam C., MocikatR. Persistence of xenogenized vaccine cells in vivo // Int. J. Cancer. 2003. Vol. 105. P 217-220.
8. Habal N., Gupta R.K., Bilchik A.J. et al. Cancer Vax, an allogeneic tumor cell vaccine, induces specific humoral and cellular immune responses in advanced colon cancer // Ann. Surg. Oncol. 2001. Vol. 8. P 389^01.
9. Hsueh E.C., Essner R., Foshag L.J. et al. Active Immunotherapy by reinduction with a polyvalent allogeneic cell vaccine correlates with improved survival in recurrent metastatic melanoma // Ann. Surg. Oncol. 2002. Vol. 9. P. 486-492.
10. Luo F., Wei Y., Kan B. Anti-tumor immune response agains mouse melanoma to xenogeneic vaccination // Zhonghua Zhong Liu Za Zhi. 2001. Vol. 23. P 118-121.
11. Parmiani G. Melanoma antigens and their recognition by T cells // Keio J. Med. 2001. Vol. 50. P. 86-90.
12. RenkvistN., Castelli C., Parmiani G. A listing of human tumor antigens recognized by T cells // Cancer Immunol. Immunother. 2001. Vol. 50. P. 3-15.
13. Srinivasan R., Wolchok J.D. Tumor antigens for cancer immunotherapy: therapeutic potential of xenogeneic DNA vaccines // J. Translat. Med. 2004. Vol. 2. P. 1-12.
14. Steitz J., Bruck J., SteinbrinkK. et al. Genetic immunization of mice with human tyrosinase-related protein 2: implications for the immunotherapy of melanoma // Int J. Cancer. 2000. Vol. 86. P 89-94.
15. Yee C., Thompson J.A., Byrd D. et al. Adoptive T cell therapy using antigen-specific CD8+T cell clones for the treatment of patients with metastatic melanoma: in vivo persistence, migration and antitumor effect of transferred T cells // PNAS. 2002. Vol. 99. P. 16168-16173.
Поступила 20.01.09
